Atome
Jedes Material, egal ob gasförmig, flüssig oder fest, besteht aus den kleinsten Materien, die man Atome nennt. Früher galt ein Atom als unteilbar, weil es das kleinste Stück Materie ist und nicht in weitere, kleinere Materien zerteilt werden kann. Daher kommt auch der Name, denn das griechische Wort "atomos" bedeutet "das Unteilbare". Mittlerweile weiß man zwar, dass Atome teilbar sind, der Name ist jedoch geblieben.
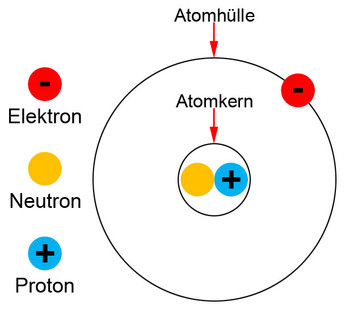
Der Durchmesser eines Atomes beträgt bei einigen 10−10 m. Das ist eine so winzige Größe, dass man sie früher unter einem Mikroskop nicht sehen konnte. Man konnte zwar nicht genau wissen, wie die Struktur eines Atoms ist, durch umfangreiche Experimente wurden jedoch verschiedene Atommodelle entwickelt, um sie zu beschreiben. Ein einfaches Atommodell besteht aus einem Atomkern und einer Atomhülle. Im Atomkern befinden sich die positiven und neutralen Ladungen. In der Hülle befinden sich die negativen Ladungen und kreisen um den Kern. Die positiven Ladungen werden Protonen genannt, die negativen Ladungen Elektronen. Neutronen sind die neutralen Ladungen.
Die Atomhülle hat kaum Gewicht, denn der Großteil der Materienmasse befindet sich im Atomkern, der wiederum ca. 100 mal kleiner ist als die Hülle. Die Anzahl der Protonen gibt die chemische Ordnungszahl der Materie an. Neutronen sind elektrisch neutral, die Masse eines Neutrons ist jedoch identisch mit dem eines Protons. Die Anzahl der Elektronen ist identisch mit der Anzahl der Protonen und somit ist Materie in der Grundform elektrisch neutral. Durch Ladungstrennung kann man erreichen, dass die Anzahl der Protonen nicht identisch ist mit der Anzahl der Elektronen und den Körper elektrisch aufladen. Ein Atom, das elektrisch aufgeladen ist, wird zu einem Ion. Den Vorgang der Ladungstrennung nennt man daher auch Ionisation.
Weitere Atommodelle
Damit man die Struktur eines Atoms genauer beschreiben kann, wurden viele Atommodelle entworfen. Zu den bedeutendsten zählen:
- Rutherford-Atommodell
- Bohrsche Atommodell
- Orbitalmodell
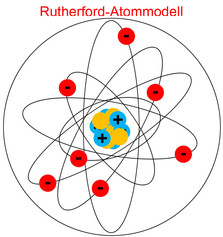
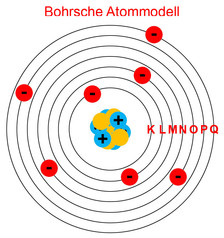
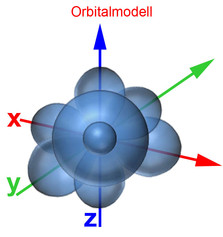
Rutherford-Atommodell
Die Grundlage für ein annährend realistisches Atommodell bildete Ernest Ruthenford. Nach seinem Modell existiert eine Atomhülle und ein Atomkern, das den grundlegenden Aufbau eines Atoms beschreibt. Im Kern befinden sich die gesamten positiven Ladungen, wo sich die größte Masse (99,9%) befindet und dementsprechend haben die Elektronen kaum Gewicht. Innerhalb der Hülle kreisen die Elektronen auf beliebigen Bahnen um den Atomkern, wodurch auch der Durchmesser eines Atoms bestimmt wird. Der Raum zwischen den Elektronen ist leer. Durch die elektrostatische Kraft zwischen den Elektronen und Protonen wird das Atom zusammengehalten. Der Durchmesser der Atome beträgt ca. 10-10 m. Rutherford konnte zwar die Existenz von Neutronen nicht nachweisen, er vermutete jedoch, dass im Kern noch eine andere Ladung sein müsste, die neutral ist und dieselbe Masse hat wie das Proton und gab hierfür den Namen Neutron.
Bohrsche Atommodell
Niels Bohr war ein Schüler von Rutherford und entwickelte das Rutherford-Modell weiter. Auch nach seinem Modell kreisen die Elektronen um den Kern, jedoch nicht auf beliebigen Bahnen. Die Elektronen haben unterschiedliche Energieniveaus und abhängig vom Energieniveau sind die Abstände zum Kern. Durch die unterschiedlichen Energieniveaus ergeben sich feste Bahnen für die Elektronen und die Atome haben eine Schalenstruktur. Die Bahnen werden dabei K-, L-, M-, N-, O-, P- und Q-Schalen genannt.
Auf der innersten Schale (K) kreisen Elektronen mit dem niedrigsten Energieniveau. Je weiter der Abstand einer Schale zum Kern ist, umso größer ist tendenziell das Energielevel. Aufgrund von Drehimpulsen können Elektronen innerhalb einer Schale unterschiedliche Energielevels haben, die mit Nebenquantenzahlen beschrieben werden. Die Hauptquantenzahlen beschreiben die unterschiedlichen Energielevels der Schalen. Man kann auch sagen, mit der Hauptquantenzahl definiert man den Abstand zum Atomkern. Die Unterschiede in den Energielevels sind nicht starr. Es kann z.B. durchaus vorkommen, dass ein Elektron mit dem geringsten Energielevel einer Schale ein höheres Energielevel hat, als das Elektron mit dem größten Energielevel der benachbarten inneren Schale.
Es gilt die Regel, dass die inneren Schalen nicht vollständig besetzt sein müssen, um äußere Schalen zu besetzen. Eine äußere Schale kann jedoch nicht vollständig besetzt werden, wenn die benachbarte innere Schale nicht bereits vollständig besetzt ist. Der Grund für das Verhalten ist das natürliche Bestreben von Atomen, energetisch den geringsten Zustand zu haben. Schalen, die nicht vollständig besetzt sind, nennt man nicht gesättigte Schalen.
Die Schalen können nicht beliebig viele Elektronen aufnehmen. Die maximale Elektronenanzahl und das Energieniveau (n) ist wie folgt bestimmt:
- K-Schale: 2 Elektronen, Energieniveau 1
- L-Schale: 8 Elektronen, Energieniveau 2
- M-Schale: 18 Elektronen, Energieniveau 3
- N-Schale: 32 Elektronen, Energieniveau 4
- O-Schale: 50 Elektronen, Energieniveau 5
- P-Schale: 72 Elektronen, Energieniveau 6
- Q-Schale: 98 Elektronen, Energieniveau 7
Die maximale Besetzung einer Schale ergibt sich aus der Formel 2 · n². Die äußersten Elektronen werden Außenelektronen oder Valenzelektronen genannt und bestimmen maßgeblich das chemische Verhalten. Valenzelektronen haben das größte Energielevel und sind am schwächsten mit dem Kern verbunden. Sofern sie keine Bindungselektronen sind, können sie sich vom Atomkern vollständig lösen und stellen frei bewegliche Elektronen im Atomgitter dar. Die Anzahl an freien Elektronen bestimmt darüber, ob und wie gut ein Werkstoff den elektrischen Strom leitet. Das Atom, wovon das Elektron gelöst wurde, wird dann zu einem Ion. Nach den "Bohrschen Postulaten" dürfen Elektronen nicht strahlen, da sie ansonsten Energie verlieren und die Bahn deshalb nicht halten können. Auch können Elektronen unter Abstrahlung von einer äußeren in eine innere Schale springen.
Orbitalmodell
Das Atommodell, das am ehesten der Realität entspricht, ist das Orbitalmodell. Das Bohrsche Atommodell kommt der Realität zwar sehr nahe, enthält jedoch einige Mängel. Beispielsweise kann man bei Quantenobjekten, zu denen auch Elektronen zählen, niemals den Aufenthaltsort und gleichzeitig den Energiegehalt genau ermitteln. Werner Heisenberg, ein bedeutender Physiker und Wissenschaftler im 20. Jahrhundert, erkannte dies und deshalb gab man für diese Unbestimmtheitsrelation den Namen "Heisenbergsche Unschärferelation".
Der Grund hierfür ist, dass Quantenobjekte einerseits Teilchen- und andererseits Welleneigenschaften (Impuls) haben. Ermittelt man den Impuls, geht die Information über der Aufenthaltsort verloren bzw. ist so ungenau, dass es unbrauchbar ist. Ermittelt man den Aufenthaltsort, ist wiederum die Information über den Impuls unbrauchbar.
Das Bohrsche Atommodell mit festen Schalenabständen und Energieniveaus entspricht nicht der Heisenbergschen Unschärferelation. Deshalb wurde das Orbitalmodell entwickelt, das dem gerecht wird. Demnach bestimmt man den Aufenthaltsort eines Elektrons zwar nicht genau, jedoch mit einer 90-prozentigen Wahrscheinlichkeit. So erhält man gleichzeitig Ergebnisse über das Energieniveau, die gut mit den gemessenen Werten übereinstimmen. Ein Orbital ist ein Raum, in dem vereinfacht gesagt ein Elektron sich mit einer 90-prozentigen Wahrscheinlichkeit aufhält. Nachfolgend die Darstellung der Orbitale vom 1. und 2. Energielevel.
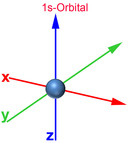
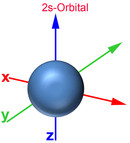
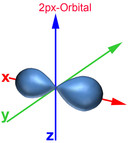
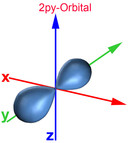
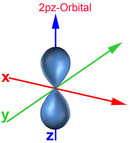
Auch im Orbitalmodell gibt es 7 Energielevel. Die Zahl am Anfang des Orbitals gibt den Energielevel an. Der Buchstabe nach der Zahl signalisiert, um was für eine Form es sich dabei handelt. Der Buchstabe s stammt vom "sharp" und signalisiert, dass es sich um eine Kugelform handelt. Beim 1s-Orbital handelt es sich somit um eine Kugel des 1. Energielevels. Der Buchstabe p stammt von "principal" und signalisiert hantelförmige Orbitale. Für weitere Formen stehen die Buchstaben d (diffuse, Doppelhantel) und f (fundamental, Rosette). Nach dem Buchstaben kann mit einem weiteren Buchstaben die Ausrichtung des Orbitals zur X-, Y- und Z-Achse bestimmt werden. Beim 2px-Orbital handelt es ich somit um einen Raum des 2. Energielevels, der hantelförmig und zur X-Achse ausgerichtet ist.