Periodensystem der Elemente (PSE)
Im 4. Jahrhundert v. Chr. hatte der griechische Philosoph Demokrit behauptet, dass jegliche Materie aus den kleinsten, unteilbaren Elementen besteht, weshalb diesen der Name "Atom" gegeben wurde, da "atomos" auf Griechisch "unteilbar" bedeutet. Demokrit war die Anzahl der verschiedenen Elemente nicht genau bekannt und er ging davon aus, dass es nur einige wenige sind, die in Kombination und unterschiedlicher Anordnung in einem leeren Raum die typischen Eigenschaften einer Materie ergeben würden. Aristoteles, ebenfalls ein griechischer Philosoph und ein Schüler Platons, lehnte diese Erklärung jedoch ab. Insbesondere störte er sich an der Vorstellung eines leeren Raumes und behauptete, dass alles aus den vier Elementen, Feuer, Wasser, Luft und Erde besteht. Diese Sichtweise hatte sich zunächst durchgesetzt und die Atome gerieten in Vergessenheit.
Erst 2000 Jahre später rückten die Atome wieder in das Blickfeld der Forschung. Da keinerlei Aufzeichnungen von Demokrit selbst existierten, blieben den Forschern lediglich die kritischen Aufzeichnungen von Aristoteles über die Behauptungen Demokrits über die Atome. Im 18. Jahrhundert untersuchten Forscher intensiv die chemische Zusammensetzung von Materien und die Behauptung von Aristoteles, dass alle Materien aus den vier Grundelementen bestehen, konnte nicht mehr aufrechterhalten werden. Denn, es wurden ständig neue Elemente gefunden und die Anzahl der Stoffe stieg bis ins 19. Jahrhundert auf ca. 60 an. Mittlerweile kennt man ca. 110 verschiedene Elemente. Das sind eigenständige Elemente, die sich selbst nicht in andere Stoffe zerlegen lassen und woraus alle Materien dieser Welt zusammengesetzt sind, auch die Körper von Menschen und Tieren.
Nach Kernladungszahl aufsteigende Sortierung des Periodensystems der Elemente
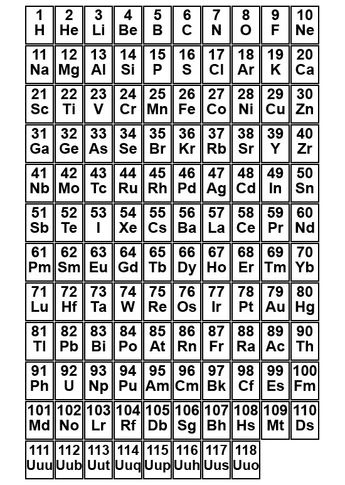
Damit man die Atomforschung systematisch betreiben konnte, begann man, die Atome einzuordnen und zu kategorisieren. Die beiden Forscher Lothar von Meyer und Dmitri Mendelejew veröffentlichten im 19. Jahrhundert zeitgleich ein Schema, in dem die Atome klassifiziert wurden und das Periodensystem der Elemente genannt wird. Das Ordnungsschema war so gut, dass man sogar die Existenz noch nicht entdeckter Elemente vorhersagen konnte und man deshalb leere Platzhalter dafür reservierte. Es entsprach fast dem System, das heute noch genutzt wird und zu den wichtigsten Werkzeugen bei der Bestimmung der chemischen Eigenschaften eines Elements gehört. Man kann sie praktisch aus einer Tabelle ablesen.
Zunächst hatte man die verschiedenen Elemente aufsteigend nach ihrer Atommasse geordnet. Man konnte damit zwar die meisten Atome in eine logische Reihenfolge bringen. Es ergab jedoch ein Problem mit den Elementen Tellur und Iod. Tellur hat eine größere Masse als Iod, konnte jedoch nicht in die nächste Spalte eingeordnet werden, da diese zu einer anderen Gruppe zählt. Zu Beginn des 20. Jahrhunderts konnte Henry Moseley beweisen, dass nicht die Atommasse das entscheidende Kriterium für die aufsteigende Sortierung der Elemente ist, sondern die Kernladungszahl (Anzahl der Protonen) der Atome. Damit ist auch das Problem mit Tellur und Iod gelöst und beide haben gemäß ihren Eigenschaften ihren logischen Platz in der Ordnungstabelle. Auf dem Bild sind alle heute bekannten Elemente aufsteigend nach ihrer Kernladungszahl aufgelistet. Wasserstoff hat z.B. nur 1 Proton, Helium 2, Lithium 3 usw. Die Tabelle ist natürlich nicht fertig und wird in den folgenden Schritten Stück für Stück gebildet.
Periodische Wiederholung der chemischen Eigenschaften

Die Kernladungszahl wird in der Tabelle als Ordnungszahl genannt und wird meistens über dem Kurzzeichen des Elements oder in der linken, oberen Ecke abgebildet. Die Ordnungszahl gibt an, wie viele Protonen ein Element enthält und die Anzahl der Elektronen ist im Normalzustand identisch. Nachdem man die Elemente nach ihrer Ordnungszahl sortiert, stellt man fest, dass (mit Ausnahme von Wasserstoff) die chemischen Eigenschaften sich periodisch wiederholen. Beispielsweise sind Lithium, Natrium, Kalium, Rubidium, Caesium, Frankium alles Alkalimetalle. Die Ordnungszahlen bei diesen sind 3, 11, 19, 37, 55 und 87. Es wiederholt sich also nach 8, 8, 18, 32 und 32 Elementen. Dasselbe gilt für alle übrigen Elemente. Beispielsweise sind die Atome mit den Ordnungszahlen 2, 10, 18, 36, 54, 86 und 118 alles Edelgase. Es wiederholt sich hier ebenfalls nach 8, 8, 18, 32, 32 und 32 Elementen.
Die um den Atomkern kreisenden Elektronen, deren Anzahl im Normalzustand identisch mit der Anzahl der Protonen ist, haben dabei eine besondere Bedeutung. Wenn man den Aufbau des Periodensystems der Elemente verstehen will, muss man die Belegung der Atome mit den Elektronen verstehen. Die Elektronen befinden sich um den Atomkern herum in den Atomschalen bzw. Orbitalen. Ein Orbital ist ein Raum, in dem die Elektronen sich mit einer Wahrscheinlichkeit von 90% aufhalten. In jedem Orbital finden nur 2 Elektronen Platz und man teilt sie in s-, p-, d- und f-Orbitale ein. Ein s-Orbital besteht nur aus einem Orbital und kann daher nur 2 Elektronen enthalten. Die p-Orbitale bestehen aus 3 Orbitalen (px, py, pz) und können 6 Elektronen enthalten. Die d-Orbitale bestehen aus 5 Orbitalen und können somit 10 Elektronen aufnehmen und die f-Orbitale können 14 Elektronen aufnehmen, da sie aus 7 Orbitalen bestehen.
Mit steigender Ordnungszahl muss man den Atomen immer mehr Elektronen hinzufügen. Die Elektronen belegen die Orbitale jedoch nicht wild durcheinander, sondern mit System. Atome haben das Bestreben, einen Zustand mit der niedrigsten Gesamtenergie zu besitzen. Deshalb gibt es 7 verschiedene Energieniveaus, die systematisch belegt werden. Jedes Energieniveau hat dabei Räume aus den s-, p-, d- und f-Orbitalen. Beispielsweise hat das 1. Energieniveau nur ein s-Orbital. Im 2. Energieniveau gibt es ein s-Orbital und drei p-Orbitale. Im 3. Energieniveau gibt es ein s-Orbital, 3-p-Orbitale und 5 d-Orbitale. Ab dem 4. Energieniveau enthält jedes Energieniveau ein s-Orbital sowie 3 p-, 5 d- und 7 f-Orbitale.
Die Elektronen belegen die energiearmen Orbitale zuerst, denn nur so haben sie einen möglichst energiearmen Zustand. Die Besetzungsreihenfolge geht tendenziell von Innen (geringes Energielevel) nach Außen (höheres Energielevel). Die Befüllungsreihenfolge ist dabei nicht exakt identisch mit den Energieniveaus. Das kommt daher, weil z.B. die d-Orbitale im 3. Energieniveau energetisch so weit liegen, dass sie erst nach dem s-Orbital im 4. Energieniveau befüllt werden. Ähnlich ist es mit den d-Orbitalen im 4. - 6. Energieniveau, die erst nach dem s-Orbital des nächsthöheren Energieniveaus befüllt werden. Auch bei den f-Orbitalen kommt es zu solchen Verschiebungen. Die Perioden werden daher wie folgt gebildet:
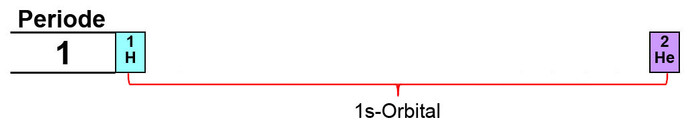
- 1. Periode = 1s-Orbital
- 2. Periode = 2s-, 2p-Orbitale (4 Orbitale)
- 3. Periode = 3s-, 3p-Orbitale (4 Orbitale)
- 4. Periode = 4s-, 3d-, 4p-Orbitale (9 Orbitale)
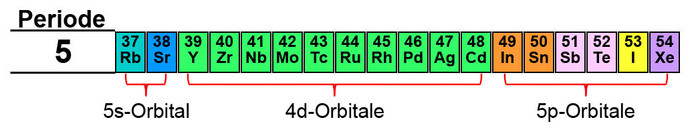
- 5. Periode = 5s-, 4d-, 5p-Orbitale (9 Orbitale)
- 6. Periode = 6s-, 4f-, 5d-, 6p-Orbitale (16 Orbitale)
- 7. Periode = 7s-, 5f-, 6d-, 7p-Orbitale (16 Orbitale)
In der 1. Periode gibt es nur 1 Orbital, worin 2 Elektronen einen Platz haben können. Ein Atom mit nur 2 Elektronen ist Helium und somit ein Edelgas. In der 2. Periode hat man 4 Orbitale und diese können 8 Elektronen enthalten. Zusammen mit der 1. Periode hätte man 10 Elektronen (2 + 8). Ein Atom mit 10 Elektronen ist Neon (Ne). Auch das ist ein Edelgas. In der 3. Periode hat man wieder 4 Orbitale und somit passen hier weitere 8 Elektronen. Zählt man die Elektronen des 1. - 3. Periode zusammen, erhält man 18 Elektronen (2 + 8 + 8). Ein Atom mit 18 Elektronen ist Argon und auch dabei handelt es sich um ein Edelgas.
Somit gelangt man zu der Erkenntnis, dass sobald die Energieschalen komplett mit Elektronen gefüllt sind (1. und 2. Periode) oder die Befüllung der p-Orbitale abgeschlossen ist (2. - 7. Periode), so dass man 8 Elektronen an der äußeren Energieschale hat, das Element ein Edelgas ist. Diese könnte man in einer Spalte untereinander anordnen.
Bestimmung des chemischen Verhaltens anhand der Valenzelektronen
Wenn es sich bei einem Element immer um ein Edelgas handelt, sobald die Energieschalen komplett mit Elektronen gefüllt sind oder die Anzahl der Außenelektronen mit jeweils 8 Elektronen identisch ist, dann müsste es sich logischerweise immer um Elemente mit ähnlichen chemischen Eigenschaften handeln, wenn die Anzahl der Elektronen an den äußeren Schalen identisch ist, z.B. wenn die äußeren Energieschalen immer mit nur mit 1 Elektron belegt sind. Dazu betrachtet man mit Ausnahme des Wasserstoffatoms die Elemente mit jeweils 1 Elektron in den äußeren Energieschalen.
In der 1. Periode passen 2 Elektronen. Besetzt man das Orbital in der 1. Periode komplett und fügt in der 2. Periode lediglich 1 Elektron hinzu, hat man 3 Elektronen (2 + 1). Das Element mit 3 Elektronen ist Lithium und das ist ein Alkalimetall. Besetzt man die Orbitale der 1. und 2. Periode komplett und fügt in der nächsten Periode wieder nur 1 Elektron hinzu, hätte man 11 Elektronen (2 + 8 + 1). Das Element mit 11 Elektronen ist Natrium und ebenfalls ein Alkalimetall. Besetzt man die Orbitale der 1. - 3. Periode komplett und fügt in der 4. Periode erneut nur 1 Elektron hinzu, hätte man 19 Elektronen. Das Element mit der Ordnungszahl 19 ist Kalium und auch das ist ein Alkalimetall.
Aus den Beispielen mit den Edelgasen und den Alkalimetallen wird deutlich, dass das chemische Verhalten eines Elements identisch mit anderen Elementen ist, wenn sie dieselbe Belegung der äußeren Elektronen haben. Man nennt die Elektronen in den äußeren Energieschalen auch Außenelektronen oder Valenzelektronen. Sind die Energieschalen wie bei der 1. und 2. Periode komplett gefüllt oder ist sind die p-Orbitale komplett gefüllt, so dass man 8 Valenzelektronen hat (2. - 7. Periode), dann handelt es sich um Edelgase. Sind die Perioden mit jeweils 1 Valenzelektron gefüllt, handelt es sich (mit Ausnahme des Wasserstoffatoms in der 1. Periode) um Alkalimetalle. Sind die Perioden mit 2 Valenzelektronen gefüllt, handelt es sich um Erdalkalimetalle usw.
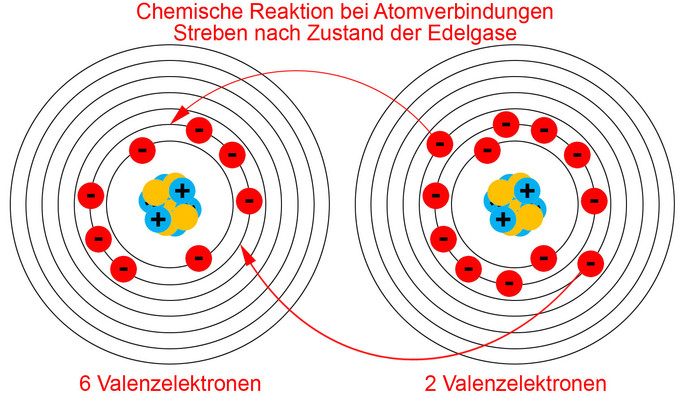
Die Anzahl der Valenzelektronen hat vor allem bei Bindungen von Atomen eine Bedeutung. Edelgase reagieren z.B. nicht mit anderen Elementen, da sie mit 8 Valenzelektronen einen sehr stabilen Zustand haben. Andere Elemente, deren Periode nicht komplettiert ist oder die weniger als 8 Valenzelektronen haben, sind immer bestrebt, den Zustand der Edelgase zu erreichen. Mischt man z.B. Elemente mit 6 und 2 Valenzelektronen, so gibt es einen Austausch und somit eine chemische Reaktion zwischen den beiden Stoffen, da das Element mit 6 Valenzelektron 2 zusätzliches Elektronen erhält und das Element mit nur 2 Valenzelektronen diese bereitwillig abgibt. Beide Stoffe reagieren auf diese Art, weil sie immer bestrebt sind, wie Edelgase zu sein. Das erklärt auch, warum Metalle gute elektrische Leiter sind. Denn, verbindet man Metallatome, geben diese alle Valenzelektronen ab, da deren Anzahl immer zwischen 1 und 3 beträgt. So werden alle Valenzelektronen zu freien Elektronen und das macht den Unterschied zwischen Leitern und Nichtleitern aus. Nichtleiter haben keine freien Elektronen.
Mit dieser Erkenntnis sowie der richtigen Reihenfolge bei der Befüllung der Orbitale mit Elektronen kann man die Tabelle mit dem Periodensystem der Elemente Stück für Stück aufbauen und dabei Elemente der gleichen Gruppe untereinander anordnen.
Aufbau des Periodensystems
Den Aufbau des Periodensystems beginnt man mit der 1. Periode. Hier gibt es nur ein s-Orbital, in dem 2 Elektronen einen Platz finden. 1 Proton und 1 Elektron ergibt Wasserstoff (H). 2 Protonen und 2 Elektronen ergeben Helium (He).
In der 2. Periode hat man ein s-Orbital und drei p-Orbitale. Im s-Orbital finden die beiden Elektronen für Lithium und Berillium einen Platz. In den übrigen p-Orbitalen finden die 6 Elektronen für Bor, Kohlenstoff, Stickstoff, Sauerstoff, Fluor und Neon ihren Platz.

In der 3. Periode gibt es wie in der 2. Periode nur ein s-Orbital und 3 p-Orbitale. Im s-Orbital finden die Elektronen für Natrium und Magnesium ihren Platz. In den p-Orbitalen werden die Elektronen für Aluminium, Silizium, Phosphor, Schwefel, Chlor und Argon abgelegt. Auch wenn im 3. Energieniveau 5 d-Orbitale existieren, werden sie in der 3. Periode nicht belegt, da sie energetisch so weit liegen, dass sie erst in der 4. Periode nach dem s-Orbital befüllt werden.

In der 4. Periode existieren alle Orbitale (s, p, d, f), wobei hier die d-Orbitale aus dem 3. Energieniveau befüllt werden. Reihen, die vom vorherigen Energieniveau sind, werden Nebengruppen genannt. Die d-Orbitale des 4. Energieniveaus werden logischerweise ebenfalls nicht in der 4. Periode befüllt, sondern erst in der 5. Periode. Die f-Orbitale des 4. Energieniveaus werden sogar erst in der 6. Periode befüllt, da sie energetisch sogar weiter als alle Orbitale des 5. Energieniveaus liegen.

In der 5. Periode ist es ähnlich wie bei der 4. Periode. Es enthält zwar alle Orbitale (s, p, d, f), die d-Orbitale werden jedoch erst in der 6. Periode befüllt und die f-Orbitale gar in der übernächsten Periode. Dafür werden die d-Orbitale des 4. Energieniveaus befüllt.
In der 6. Periode werden zum ersten Mal alle Orbitale (s, p, d, f) befüllt, wobei die f-Orbitale aus dem 4. Energieniveau stammen und die d-Orbitale aus dem 5. Energieniveau. Die Reihenfolge der Befüllung ist (s, f, d, p). Aus Platzgründen setzt man die Elemente, für die die Elektronen in den f-Orbitalen abgelegt werden, in eine zweite Reihe. Die Elemente dieser Reihe werden Lanthanide oder Seltene Erden genannt.
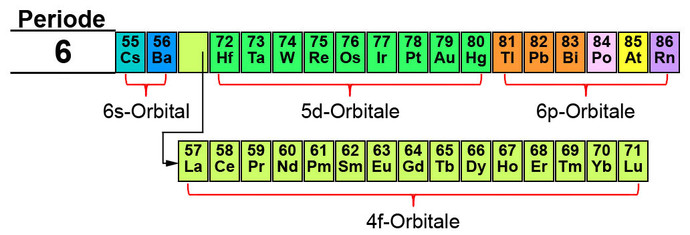
Mit der 7. Periode wird das Periodensystem der Elemente komplettiert. Auch hier werden die Orbitale in der Reihenfolge s, f, d und p befüllt. Die f-Orbitale stammen aus dem 5. Energieniveau und die d-Orbitale aus dem 6. Energieniveau. Aus Platzgründen werden die Elemente mit den f-Orbitalen wieder eine Zeit nach unten gesetzt. Diese werden auch Aktinide genannt.
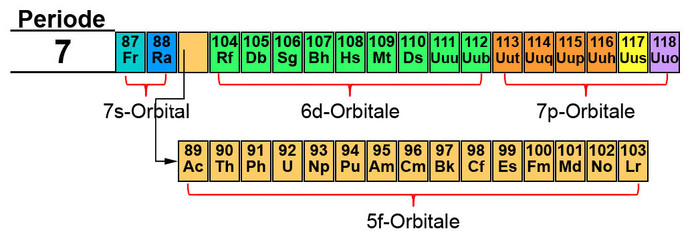
Das komplette Periodensystem der Elemente
Setzt man die einzelnen Perioden zusammen, erhält man das komplette Periodensystem der Elemente. Farblich identische Elemente haben ähnliche bzw. gleiche chemische Eigenschaften. Die Spalten werden in Haupt- und Nebengruppen unterschieden. Die Hauptgruppenzahl gibt gleichzeitig die Anzahl der Valenzelektronen an. Bei der neuen Gruppierung nach (IUPAC) International Union of Pure and Applied Chemistry wird nicht mehr zwischen Haupt- und Nebengruppen unterschieden. Stattdessen erhält jede Spalte eine Gruppennummer. Viele Periodensystem enthalten weitere Informationen über die Elemente wie z.B. die Masse, ob es fest, flüssig oder gasförmig ist, ob es natürlich vorkommt oder künstlich hergestellt wird etc.
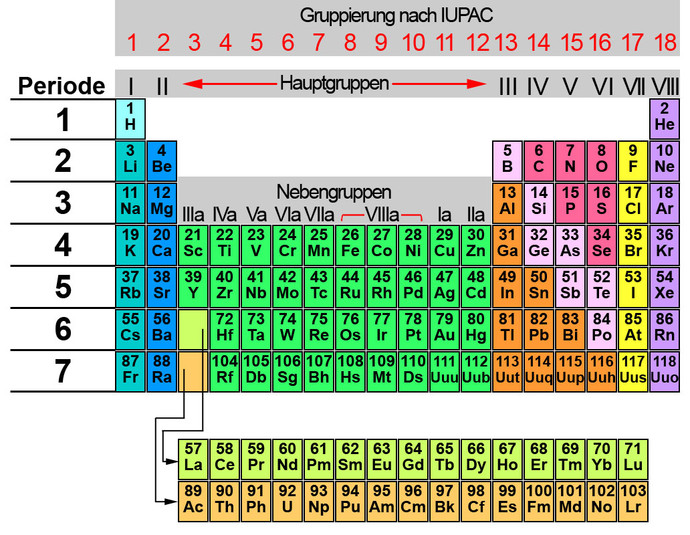
Auffällig bei dem Ordnungsschema ist, dass (mit Ausnahme des Wasserstoffatoms) die Metalle sich auf der linken Seite befinden und die elektrisch nichtleitenden Stoffe auf der rechten Seite. Die Halbleiter befinden sich genau zwischen den elektrisch leitenden und den nichtleitenden Stoffen. Theoretisch könnte man das Periodensystem der Elemente beliebig fortsetzen, indem man jeweils ein Proton und ein Elektron hinzufügt. Das letzte Element mit der Ordnungszahl 118 wurde künstlich hergestellt. Jedoch zerfällt es bereits in Millisekunden und die Zeit reicht grade aus, um es nachzuweisen.